生物疗法可能在患者体内诱发不良的免疫原性反应,从而导致抗药物抗体(ADA)的发展[1] 。中和抗体(NAbs)是ADAs的一个子集,它抑制药物与靶标的结合,中和药物的作用,使其不具有生物学活性。此外,当药物是内源性蛋白质时,NAbs可能与药物的内源性类似物发生交叉反应,这可能对药物安全性产生不良影响。研究表明NAbs的存在可能对临床参数如药代动力学(PK)、药效学(PD)、有效性和安全性有一定影响 [2] 。
在药物捕获和靶点捕获模式中的竞争性配体结合NAb分析方法要求:a. 在药物捕获方法检测中,样品与生物素化的药物孵育,并转移到亲和素包被的微孔板中,并在随后的步骤中将钌标记靶点添加到微孔板中。在没有NAb的情况下,钌标记的靶标与固定化的生物素药物结合,在实验中产生信号。在NAb存在的情况下,钌标记的靶标不能与固定化的生物素药物结合,从而抑制检测信号。b. 在靶点捕获方法检测中,生物素化的靶标首先与亲和素包被的微孔板结合。样品与钌标记药物孵育,然后加入微孔板中。在没有NAb的情况下,钌标记的药物与固定化的生物素靶点结合,在实验中产生信号。在NAb存在的情况下,钌标记的药物不能与固定化的生物素靶点结合,从而抑制检测信号 [4]
。
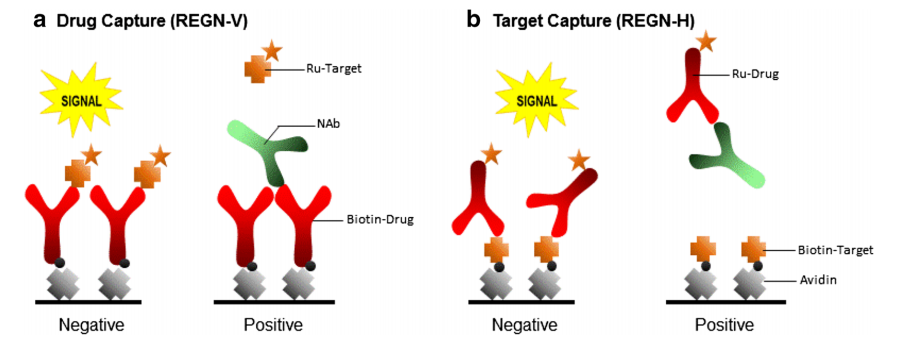
图1: 竞争性配体结合分析[4]
1、临界值确定
正态分布:临界值=anti-log{(logS-2.326*SD)}
非正态分布:临界值=99百分位(1%假阳性)
2、 灵敏度
3、 药物耐受性
用空白人混合基质稀释药物至合适系列浓度,用该系列药物与空白的 人混合基质稀释的不同浓度阳性质控以 1 : 1 混合后,在室温中共同孵育至少 60 min 后于 -65℃~-90℃ 冰箱中冷冻至少 12 h 后再分析。在不同浓度的阳性对照存在的情况下,信号值低于临界值时所对应的最高药物浓度即为该浓度阳性对照样品能够耐受的最大药物浓度。
由于NAb在样品中会有两种存在形式,即游离NAb和NAb-药物复合物。游离的NAb 相对比较容易检测到,而对于NAb-药物复合物需要对样品进行预处理,目前主要的预处理方法有吸附去除游离药物、酸解离、磁珠提取和酸解离(BEAD)、固相提取和酸解离(SPEAD)等方法。
(1)酸解离[5]
:是较为常见预处理方法。酸解离是通过酸化样品来实现将NAb-药物复合物解离成NAb和药物,但这仅是在酸性条件下的存在形式,酸化后的样品需要在pH值调回到中性时方可被用于NAb的检测。酸处理可以分解药物-靶点复合物,可能会将游离靶点释放到样品基质中,导致假阳性结果。但酸解离的最大目的是使得原来已与药物结合的抗药抗体至少有部分可以被检测到。常见的酸有乙酸、甘氨酸、乳酸等。
(2)BEAD[6]
:将SA包被的磁珠(10mg/ml),在管状磁力架上用2ml分析缓冲液稀释并洗涤2次,重悬于1800ml分析缓冲液中,并加入200μl生物素化药物,在室温下重悬30分钟。用分析缓冲液洗涤并重悬。然后将微球移入96孔微孔板中,去除分析缓冲液,加入pH 9.0 的Tris溶液。待测样本用300 mM甘氨酸(pH 2.5)酸化处理,取200μl/孔酸化处理的样本加到96孔磁珠上,室温孵育30分钟,用分析缓冲液洗涤两次,加入100μl pH 2.5的甘氨酸孵育15分钟,然后转移洗脱液75μl到另一个含有25μl/孔的Tris 溶液的96孔板中,反应物用于后续样本检测。
(3)SPEAD[7]
:待测样本用100mM甘氨酸酸化处理5min(第一次酸化),后加入 Biotin-药物,反应5min,取酸化样本加入含有1M Tris溶液的SA-HBC板子中,中和反应5h,洗涤后加入100mM甘氨酸反应5min(第二次酸化);在包被有靶蛋白抗体的板子中,先加入1 M Tris溶液,再加入第二次酸化后的样本,室温孵育过夜以捕获游离靶蛋白,过夜孵育的待测样本用于后续Nab检测。
4、 靶点干扰
5、 选择性和基质干扰
选择至少10 个健康人个体样本,添加阳性质控样品。对 10 个个体样本(加标和未加标)以及加标和未加标的混合基质( NC )进行了测试。计算 NAb 加标样本的回收率,回收率 %=100* (加标个体样本 / 加标 NC 样本)。回收率的接受范围为 75%-125% 。 10 个个体样本中至少有 8 个个体样本( 80% )必须通过验收标准。未加标的 10 个个体样本中至少有 8 个个体样本( 80% )的检测结果高于临界值。
6、 稀释线性
为了评估稀释线性的关系,在混合基质中加标阳性对照样品,先用空白混合基质稀释加标样本三个稀释度(如1:2、1:3和1:9),再分别进一步以3倍系列稀释至8个浓度的样本。比较稀释线性样本间滴度值的差异,以确定方法的线性稀释范围。
7、精密度和稳健性
8、稳定性
[1] Mire-Sluis AR,et al.Recommendations for the design and optimization of immunoassays used in the detection of host antibodies against biotechnology products. J Immunol Methods. 2004;289(1-2):1-16
[2] Hu J,et al.Comparison of cell-based and non-cell-based assay platforms for the detection of clinically relevant anti-drug neutralizing antibodies for immunogenicity assessment of therapeutic proteins. J Immunol Methods. 2015;419:1-8
[3] Jenny Hu, et al.Comparison of cell-based and non-cell-based assay platforms for the detection of clinically relevant anti-drug neutralizing antibodies for immunogenicity assessment of therapeutic protein.Journal of Immunological Methods.2015.
[4] Michael A. Partridge, et al.Drug Removal Strategies in Competitive Ligand Binding Neutralizing Antibody(NAb) Assays: Highly Drug-Tolerant Methods and Interpreting Immunogenicity Data.The AAPS Journal.2020, 22:112.
[5] Bonnie Wu, et al. Approaches to improve drug tolerance and target tolerance in the assessment of neutralizing anti-drug antibodies.Bioanalysis (2019) 11(22), 2061-2074.
[6] Vitaly Ablamunits,et al.A competitive ligand-binding assay to detect neutralizing antibodies to a bispecifc drug using a multiplex Meso Scale Discovery platform.Bioanalysis (2021 ) 1 3(22), 1 659-1 669.
[7] Yuhong Xiang, et al.Neutralizing Antibody Assay Development with High Drug and Target Tolerance to Support Clinical Development of an Anti-TFPI Therapeutic Monoclonal Antibody.The AAPS Journal (2019) 21:46.
[8] <1106.1>Immunogenicity Assays-Design and Validation of Assays to Detect Anti-Drug Neutralizing Antibody(official,2015-08-01).
[9] 《药物免疫原性研究技术指导原则》,NMPA, 2021.03.
央视《匠心》栏目视角看迈杰转化医学