
急性呼吸道疾病的发病率和病死率占据了急性疾病的发病率和病死率很大比例,而这其中由于病毒感染引起的呼吸道感染最多(大约80%)。最主要的致病性病毒包括流感病毒(Influenza Virus), 呼吸道合胞病毒(Respiratory Syncytial Virus), 冠状病毒(Coronavirus),腺病毒(Adenovirus)和鼻病毒(Rhinovirus)。全世界每年有30万5岁以下的幼童病死于流感病毒和呼吸道合胞病毒感染。其它呼吸道病毒,像腺病毒和鼻病毒虽然病死率低,但是发病率却很高,造成了大量经济负担。时下,严重致病的冠状病毒,包括严重急性呼吸综合征冠状病毒(Severe Acute Respiratory Syndrome Coronavirus,SARS-Cov)和中东呼吸综合征(Middle East Respiratory Syndrome Coronavirus, MERS)给全球造成的公共卫生冲击大家也有目共睹。由于上述病毒都能造成上呼吸道和下呼吸道的感染,同时临床症状又相似,使得医生很难对症下药,此时准确又快速检测病毒感染的技术则至关重要。表一中总结了呼吸道病毒和其特异性的诊断方法。

表1. 呼吸道病毒及其诊断方法1

流感病毒的检测
流感病毒属于正黏病毒科,基于核蛋白和基质蛋白的不同分为6个属,包括流感病毒A、B 、C 、D、传染性鲑鱼贫血症和托高土(索戈托)病毒属(国内将流感病毒A、B 、C又分别称为甲、乙、丙型)。其中具有临床症状的只有流感病毒A和B。流感病毒B常造成局部爆发,流感病毒A则是大规模流感流行的主要原因。根据病毒表面血凝素(ha)和神经氨酸酶(na)的抗原性特点,人们将甲型流感病毒进一步分为许多亚型。到目前为止,已经发现了18种不同的血凝素亚型(H1-H18)和11种神经氨酸酶亚型(N1-N11)。1980年,WHO公布了流感病毒新的统一命名法。甲型流感病毒的命名内容和顺序是:型别/宿主/分离地点/毒株编号/分离年代(血凝素抗原亚型和神经氨酸酶抗原亚型)。
传统的诊断方法,如病毒培养和直接/间接免疫荧光测定法(IFA),既耗时又费力并且灵敏度有限。其中病毒培养是流感病毒诊断的金标准,包括用临床样本接种鸡胚和细胞培养,比如马达犬肾细胞(MDCK)和恒河猴的原代猴肾细胞,一般培养时间达10天后监测细胞病变效应(CPE, cytopathic effect), 最后用抗体染色或者荧光显微镜确认流感病毒。美国FDA已批准了若干基于ELISA的流感诊断试剂盒,但是ELISA的检测常常敏感性不如分子诊断的核酸检测。
基于PCR的核酸检测,不依赖病毒抗原或者抗体,可以识别不同的流感病毒亚型。反转录PCR、环介导等温扩增(LAMP)、芯片及测序技术已经开始应用于流感检测。据报道一项LAMP技术可以对临床来源的季节性甲型流感病毒(H1N1 和 H3N2) 达到100%的灵敏度,每个反应可检测10个拷贝的病毒。联合纳米芯片和NGS,有平台技术可以在一管临床样本中同时满足筛查和确诊甲型和乙型流感的需求。最近,基于三代测序仪MinION的全基因组测序技术可用于检测甲型和乙型流感病毒,经二代测序仪Miseq验证结果后,MinION 1D reads整体的准确度,精确度和敏感度分别为99.95%,97.88%和89.41%; 2D reads整体的准确度,精确度和敏感度分别为99.97%, 99.86%和93.28%。

呼吸道合胞病毒检测
人类呼吸道和胞病毒(RSV)是反义单链RNA病毒。RSV的基因组有10个基因,共编码11种蛋白质。根据基因组序列和单克隆抗体(mAbs)对表面糖蛋白和融合蛋白的反应 ,RSV可分为A和B亚型。RSV是免疫缺陷人群严重呼吸道疾病的主要致病因子,在世界范围内发病率和死亡率都很高。早期和准确的诊断RSV对合适的治疗至关重要。
传统检测呼吸道和胞病毒的方法是ELISA和免疫荧光,免疫荧光可以使用荧光标记的一抗或二抗快速检测RSV的抗原。具体的,直接荧光抗体法(DFA)要求标本中有一定数量的细胞,其灵敏度和特异性分别为94%和96.8%,因其简便和快速而被临床实验室广泛用于RSV的检测。半导体量子点因其独特的尺寸依赖的光学和电子特性,可用于检测RSV。利用巯基乙酸盐(TGA)包被碲化镉(CdTe)微粒,CdTe微粒与抗RSV F蛋白mAb偶联,检测RSV的F蛋白。它克服了DFA法的背景染色,荧光染料快速漂白等缺点。通过QDs检测F蛋白和G蛋白,共聚焦显微镜可以检测到HEp-2细胞系RSV感染的进展。
另一种快速RSV检测方法是基于免疫层析技术的侧流免疫分析法(Lateral Flow Immunoassay, LFIA)使用的是鼻腔洗液或分泌物样本。目前市场上有许多LFIA试剂盒,如BD Directigen EZ RSV、Binax now RSV、RSV Respi-Strip、Remel Xpect、QuickLab RSV test等。上述试剂盒的敏感性和特异性通常高于90%和95%,但不同制造商之间有差异。
巢氏反转录PCR也可用于检测RSV,通常需依据RSV F基因设计外向和内向引物。TaqMan RT-qPCR技术则对N基因和F基因设计2套引物,提高了检测的灵敏度。在75例有呼吸道症状儿童的鼻咽分泌物中,TaqMan RT-qPCR共检出36例RSV阳性样本。相比之下,基于细胞培养的分析只鉴定出21个RSV阳性标本,免疫荧光分析鉴定出32个RSV阳性标本,表明TaqMan PCR检测具有更高的准确性和敏感性。逆转录重组酶辅助扩增法(RT-RAA)主要利用酶混合物(单链DNA结合蛋白SSB、重组酶UvsX和DNA聚合酶)来检测RSV的RNA扩增子。在39°C条件下,30分钟内,RT-RAA可以高特异性完成扩增,区分RSV的A和B亚型。此外,逆转录链侵入扩增法(RT-SIBA)是RSV的逆转录等温核酸扩增快速检测法,具有良好的敏感性,可以在20 min内检测10拷贝的RSV RNA。RT-SIBA法检测RSV时不需要高纯度RNA,可以减少样品制备的复杂性和缩短总的临床标本检测周期。

冠状病毒检测
到目前为止,6种人类冠状病毒(HCoVs) 已经被确定,它们是HCoV-229E、HCoV-HKU1、HCoV-OC43、HCoV-NL63、严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)。对冠状病毒的诊断方法是RT-PCR、实时逆转录PCR (rRT-PCR)、逆转录环介导的等温扩增(Reverse Transcription Loop-mediated isothermal amplification, RT-LAMP)和实时RT-LAMP法等。
例如一种双重RT-PCR检测方法是针对 SARS-CoV和MERS-CoV刺突S2基因的保守区域设计的引物和探针,以pUC57SARS-pS2做为SARS-CoV的模板,pGEM-MERSS2做为MERS-CoV模板进行检测,检测限可达50-100拷贝/mL。采用单重RT-iiPCR法(反转录恒温热隔绝式PCR)分别检测MERS-CoV包膜基因(upE)和开放阅读框1a (ORF1a)基因,与单重RT-qPCR方法相比,RT-iiPCR检测MERS-CoV ORF1a和upE RT-iiPCR方法的灵敏度分别为99.03% 和100%。针对MERS-CoV ,已有6个基于rRT-PCR的商用检测试剂盒。这些试剂盒大多靶向upE和ORF1a基因,与其他呼吸道病毒未见交叉反应。根据28个特异性参考品盘和9个临床标本的验证试验,所有这些rRT-PCR试剂盒检测upE和ORF1a的灵敏度和特异性分别达到100%(95% CI: 0.60-1.00)和100%(95% cl :0.79-1.00)。
对于COVID-19的核酸检测,国内公司采用的都是实时荧光RT-PCR技术,主要分为两类:二重实时荧光RT-PCR和三重实时荧光RT-PCR(均为Taqman探针法)。二重检测的靶基因主要是ORF1ab基因和N基因;三重是ORF1ab基因、N基因和E基因。部分试剂的性能如下表。
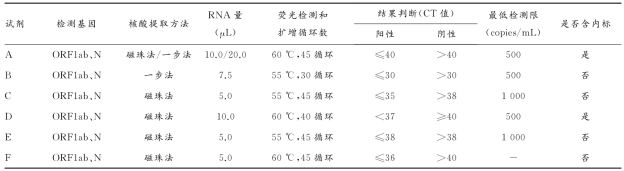
表2. 部分冠状病毒检测试剂性能分析汇总3

腺病毒检测
腺病毒(HAdV)为无包膜的双链DNA病毒,分为A-G共7个亚属,目前已发现至少50个血清型。与呼吸道疾病相关的腺病毒主要为B、C和E亚属腺病毒,病原学监测数据显示,B亚属HAdV-7和HAdV-3是引起我国呼吸道感染性疾病主要的腺病毒型别,C组的HAdV-1和HAdV-2特别是在我国南方地区不少见;HAdV-55在我国呈逐渐广泛流行趋势。
传统检测腺病毒的金标准方法是细胞培养后分离腺病毒,并用免疫学方法检测,比如血凝抑制试验(HI)检测五邻体蛋白的抗原决定簇和中和试验(NT)检测六邻体蛋白的抗原决定簇来进行分型。这些方法耗时长,需要有经验的技术人员,结果也具有不确定性。其它方法包括:间接ELISA法检测人血清或血浆中hAdV的IgA、IgM、IgG抗体;免疫荧光(IF)、乳胶凝集试验(LAT)和酶免疫分析(EIA),因为这些方法具有简单、快速的特点,是临床实验室普遍采用的诊断方法。
分子技术的发展为腺病毒的诊断提供了更加全面可靠的方法,也在逐渐替代传统的方法。分子诊断腺病毒主要是依据六邻体蛋白的抗原决定簇 L1和L2环的高变(Hypervariable Region,HVR)区域设计靶标,其中HVR 1-7已经成为腺病毒分型选择的最新方法。据报道一种两步诊断方法,通过扩增和测序L1和L2基因可以有效分类51种血清型。
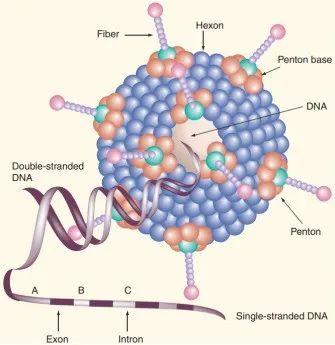
图1. 腺病毒结构(来源网络)

鼻病毒检测
鼻病毒(RVs)为二十面体对称衣壳的单链RNA病毒,分为A、B、C三个种,共有160种血清型。RV- A和RV-C是常见的种类,可引起下呼吸道疾病、喘息和急性哮喘,相较RV- B在儿童中可导致更严重的症状。
病毒培养联合酸稳定测试(acid stabilization test)是检测RVs的经典方法,但是耗时耗力,在临床中的价值不高。针对RVs的抗体,可用的免疫方法包括补体结合(CFT)、血凝抑制(HI)、免疫荧光、ELISA等,但是由于缺乏合适的交叉反应抗原来覆盖足够数量的鼻病毒血清型,限制了免疫方法的使用。相反,一步法实时PCR方法检测基因序列显现了巨大价值,克服了免疫法的缺陷。实时PCR可以减少样本处理时间,消除cDNA从反转录到PCR过程中的交叉污染。例如一步法Panenterhino/Ge/08实时RT-RCR测定方法已开发成功,通过使用提取内参和连续稀释的体外转录的鼻病毒进行了验证。此检测的LOD和定量检测限(LOQ)分别为1000 copies/ml和10000 copies/ml,其分析内重现性r2=0.999。随着全基因组测序(WGS)技术的快速发展,越来越多的实验室可以在临床上对人RV分离株进行WGS检测。

多重检测呼吸道病毒
尽管单个呼吸道病毒被检出,但是并不能排除其它病毒不存在,尤其是5岁以下的幼童,常常合并感染的概率很高。在一个管中包含多个病毒基因靶点的多重检测法比单重检测具有短时间内快速确诊的优势。例如NxTAG Respiratory Pathogen Panel(NxTAG-RPP)是一种新型高通量多重实时PCR检测系统,对对多种呼吸道病原体的检测具有良好的诊断效果。这个系统共检测了包括hAdV、RV在内的284例临床呼吸道标本和3例A/H7N9流感病毒培养标本,整体诊断敏感性为98.9%(95% CI),特异性为99.0%(95% CI)。
下表总结了部分多重检测的方法和涉及的病毒种类。
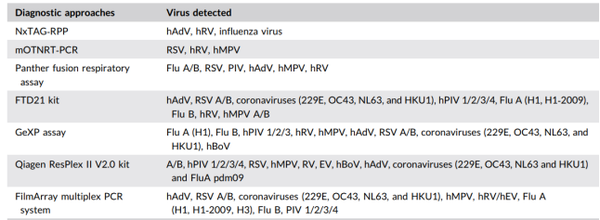
表3. 部分多重检测的方法和涉及的病毒种类1

总结
病毒感染是呼吸道感染出现临床症状的首要原因,并且可以感染所有年龄段人群,及时和准确的诊断病毒的类型是精准治疗的前提。病毒易于由于点突变而产生抗原偏移和新的菌株,给传统的检测方法和分子检测都带来了巨大挑战。而随着NGS技术的发展,低成本的快速全基因组测序,转录组测序和外显子测序可以很大程度改善临床诊断的困境。相比传统诊断防范,合并感染的重症患者或者未知的感染的患者更可能从NGS辅助诊断中的获益。
迈杰转化医学病原微生物宏基因组检测项目
SPI-seq(Speed Pathogen Identification Sequencing)是迈杰转化医学基于宏基因组高通量测序技术的全面、准确、快速的病原诊断解决方案。通过对受试者血液、脑脊液、肺泡灌洗液等样本中的核酸进行高通量测序,结合迈杰转化医学自建病原微生物知识库,可实现13000+种病原微生物的准确识别,同时可获取耐药基因信息,为临床提供及时有效的诊断依据,辅助临床决策。
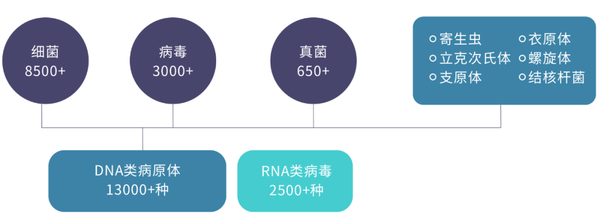
图2. SPI-seq的病原微生物覆盖范围
文献:
1. Zhang, NR; Wang, LL; Deng, XQ et.al. Recent advances in the detection of respiratory virus infection in humans. Journal of Medical Virology. 2020, 92 (4): 408.
2. Schibler M, Yerly S, Vieille G, et al. Critical analysis of rhinovirus RNA load quantification by real‐time reverse transcription‐PCR. J Clin Microbiol. 2012, 50:2868‐2872.
3. 郭元元, 王昆, 张宇,等. 6种国产新型冠状病毒核酸检测试剂检测性能比较与分析[J]. 重庆医学, 2020, 49(00):E023-E023.

迈杰转化医学入驻以下平台
知乎/百家号/今日头条/搜狐号一点资讯/百度贴吧/视频号/新浪微博简书/抖音/小红书/千聊/健康界/雪球
内容 | 杨玉霞
排版 | Sally
校正 | Grace/张超/Sally/许晓雪
央视《匠心》栏目视角看迈杰转化医学