过继性癌症免疫疗法:一种采用体外扩增的转基因或天然自体的T细胞,用于治疗癌症患者的方法。目前过继治疗法主要基于嵌合抗原受体CAR-T细胞或肿瘤浸润淋巴细胞TIL进行。
CAR-T细胞是从患者外周血中分离出的多克隆T细胞,经过基因工程改造,可表达具有针对已知肿瘤相关抗原(TAA)的单克隆抗体特异性的CAR,并具有共刺激信号转导能力。相反, TIL的治疗是利用T细胞对肿瘤的自然浸润,作为其识别肿瘤抗原的能力和免疫治疗潜力的指征。肿瘤浸润淋巴细胞是在肿瘤的抑制条件下,从切除的肿瘤组织中分离出来,并在体外刺激培养。尽管与其他过继细胞疗法相比,TIL具有独特的优势,包括广泛的TCR多样性、相对安全性和有效的肿瘤归巢,但其广泛应用仍面临主要挑战,包括不同患者和不同类型肿瘤的临床缓解率不同、生产扩增产率的差异、具有不同治疗能力的T细胞克隆的不可预测的扩增,以及TIL的长期扩增可能导致功能受损的风险,如T细胞衰竭或无能。
TIL细胞表型具有异质性。一般来说,TIL中绝大多数细胞CD3阳性。不同肿瘤来源的TIL细胞中,CD4+T细胞、CD8+T细胞的比例有差异。大多数情况下以CD8+T细胞为主。新鲜分离的TIL中CD25+细胞百分率较低,随着体外加IL-2培养时间的延长,CD25+细胞百分率逐渐升高。NK细胞的标记(CD16,CD56)在 TIL体外加IL-2培养过程中有先增高后降低的趋势。
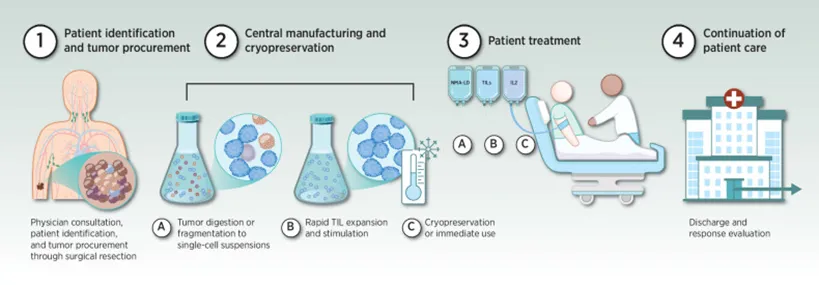
(1) 获得病人的肿瘤组织块,其中混杂着体积较大的肿瘤细胞以及体积小而圆的T淋巴细胞;
(2) 肿瘤样本被运送到专有的GMP设施,在那里TIL被分离并繁殖,将不同种类的T淋巴细胞在细胞板上克隆化,并加入高浓度的IL-2来选择培养,在三周内产生数十亿TIL。
(3) 在IL-2的刺激下不同种类的T淋巴细胞都得到了克隆扩增,形成了细胞群;
(4) 用病人的肿瘤细胞和扩增后的T淋巴细胞反应,凡是能够发生杀瘤效应的T淋巴细胞群作为阳性TIL群留下,其余的丢弃;
(5) 用负载了肿瘤特异性抗原的树突状细胞(DC)进一步扩增培养肿瘤特异性的TIL;
(6) 患者开始一周的预处理治疗(清髓)以准备接受TIL。TIL产品作为一次性疗法使用,在TIL输注后立即接受多达6剂白细胞介素2(IL-2),来支持患者体内TIL的生长和激活。
由于TIL在病人体内经过天然选择和富集,含有识别肿瘤特异性突变抗原的T细胞,且细胞亚群多样性丰富,具有多靶点、肿瘤浸润性好、肿瘤特异性强、安全性高等优点,在实体瘤临床治疗上展现了巨大潜力,尤其在转移性黑色素瘤、头颈部鳞状细胞癌、宫颈癌、非小细胞肺癌等实体瘤治疗领域展现出了显著的临床疗效。
肿瘤浸润淋巴细胞(TIL)的过继性细胞治疗已经在一些实体瘤中显示出有前景的临床益处,但这种治疗的疗效可能会因TIL的“易衰竭”表型和较差的体内持久性而受到影响。这就需要一个强大的扩增过程来产生大量的细胞用于临床,同时保持良好的抗肿瘤功能和记忆表型。
2024年2月16日,Iovance
Biotherapeutics公司宣布Lifileucel(LN-144)获得美国食品和药物管理局(FDA) 批准上市,用于治疗PD-1抗体治疗后进展的晚期黑色素瘤,商品名为AMTAGVI™。这是全球首款获批上市的TIL疗法,也是全球首款获批的用于治疗实体瘤的T细胞疗法,具有里程碑的意义!
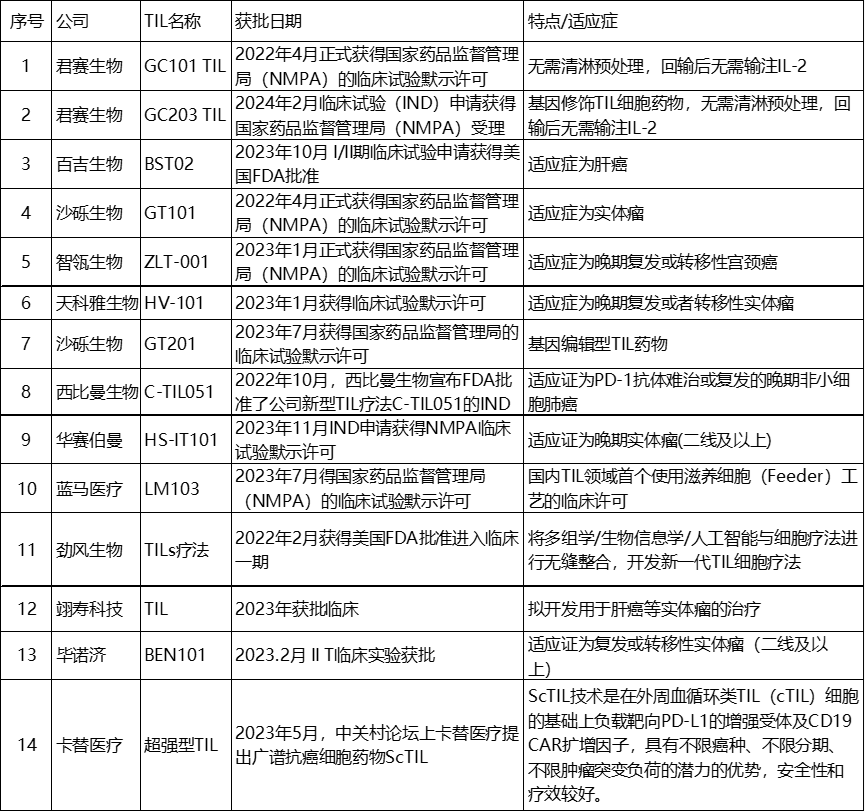
作为一种高度差异化和个体化的过继性细胞疗法,TIL疗法在有效性和可及性上仍然面临诸多挑战,其中一条就是难以获得具有抗肿瘤活性、增殖能力强的TIL,而肿瘤微环境中TIL组成的复杂性和差异化也还需要更深入的研究。
参考文献
[1] Foppen MHG , Donia M , Svane IM , Haanen JBAG .
Tumor-infiltrating lymphocytes for the treatment of metastatic cancer. Mol
Oncol 2015;9:1918–35.
[2] Sharon Yunger, et al. Modulating the proliferative and cytotoxic
properties of patient-derived TIL by a synthetic immune niche of immobilized
CCL21 and ICAM1. Published online 2023 Mar
3. Front Oncol. 2023;
13: 1116328.
[3] Hao Feng,
et al. Modulation of intracellular kinase signaling to
improveTIL stemness and function for adoptive cell therapy. Cancer Med. 2023 Feb; 12(3): 3313–3327.
![]()
![]()