
2021年12月31日,恒瑞医药研发的“羟乙磺酸达尔西利片”正式获得国家药品监督管理局(NMPA)批准上市,联合氟维司群用于既往接受内分泌治疗后出现疾病进展的激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的复发或转移性乳腺癌患者,成为首个获批上市的国产CDK4/6抑制剂。2022年1月6日,礼来宣布其抗肿瘤新药“阿贝西利片”(商品名:唯择)获得NMPA批准,联合他莫昔芬或芳香化酶抑制剂等内分泌治疗,适用于HR阳性、HER2阴性、淋巴结阳性、高复发风险且Ki-67≥20%早期乳腺癌成人患者的辅助治疗。由此,阿贝西利成为中国大陆首个且当前唯一被批准用于早期乳腺癌患者的CDK4/6抑制剂。乳腺癌是全球女性中最常见的癌症,在我国每年约有16.9万女性乳腺癌,是女性第二位最常见恶性肿瘤。CDK4/6抑制剂联合内分泌治疗已经成为目前HR阳性,HER2阴性乳腺癌患者的标准治疗方案。据研究,有90%以上的HR /HER2-乳腺癌患者可以从CDK4/6抑制剂内分泌治疗中获益,CDK4/6抑制剂的出现改变了这些患者的治疗结局,可以有效克服或延迟内分泌抵抗的出现,为他们争取更长的生存时间。
基于综合性转化医学研究平台,迈杰转化医学研究(苏州)有限公司(以下简称迈杰)已经积累了丰富的生物标志物检测经验,可以针对CDK4/6抑制剂的药物临床研究为合作伙伴提供完整的解决方案。

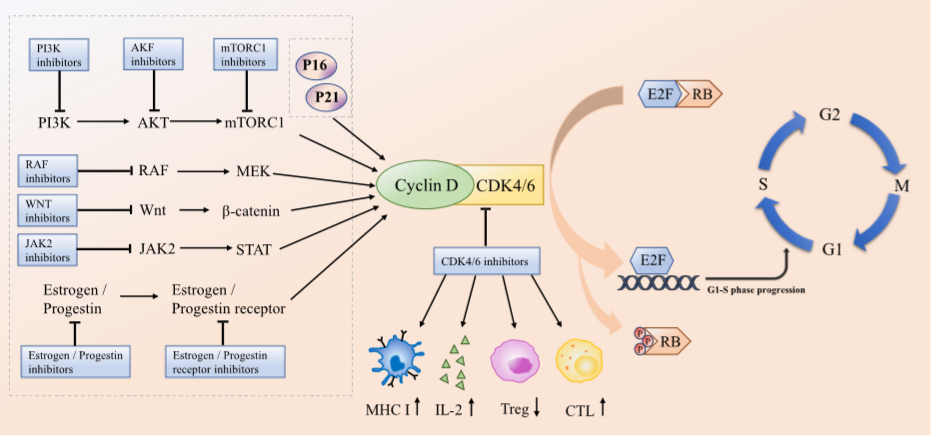
图1 CDK4/6在细胞周期中的作用[1]
CDK(Cyclin-dependent Kinase)全称为“细胞周期蛋白依赖性激酶”,是一种调控细胞生长和分裂的关键因子,CDK4/6即“细胞周期蛋白依赖性激酶4/6”。CDK4和CDK6有71%的氨基酸同源性,均能与D型细胞周期蛋白(Cyclin D)的3种亚型(Cyclin D1/2/3)结合,形成活性Cyclin D-CDK4/6复合物,促使抑癌基因Rb磷酸化,导致转录因子E2F从Rb-E2F复合物解离,使细胞从G1期进入S期并启动 DNA 复制[1]。在乳腺癌、胰腺癌、肾癌、肝癌和血液系统肿瘤等许多肿瘤的成瘤过程中已经观察到Cyclin D-CDK4/6-Rb通路的变化 [2-6]。基因扩增、基因突变以及Cyclin D、CDK4和CDK6上游和下游调节因子的异常都可以导致Cyclin D CDK4/6-Rb通路的异常激活[7, 8]。CDK4/6在细胞周期中的核心调控作用说明了其作为治疗恶性肿瘤靶点的重要作用(图1)。

当前上市的CDK4/6抑制剂的作用机制可以分为2种:抗肿瘤和保护骨髓。其中治疗HR﹢/HER2-早期、晚期或转移性乳腺癌体现的是其抗肿瘤机制,如:哌柏西利、利柏西利和阿贝西利,而在广泛期小细胞肺癌中预防化疗引起的骨髓抑制体现的是其保护骨髓机制,如:曲拉西利。
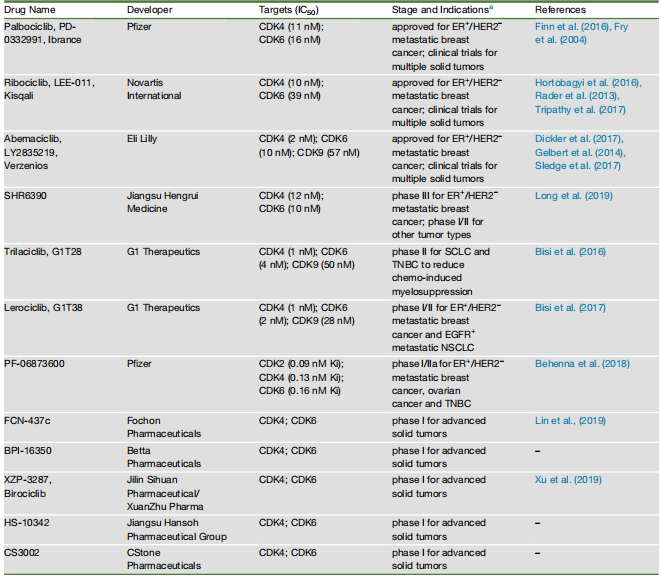
表1 CDK4/6 Inhibitors in Active Clinical Trials[9]
乳腺癌病例中约30%具有Cyclin D1基因扩增。在雌激素受体阳性(ER+)乳腺癌细胞系中,周期蛋白D1和CDK4/6促进视网膜母细胞瘤蛋白 (Rb) 的磷酸化、细胞周期的进程和细胞增殖,导致细胞增殖失控。连续暴露于CDK4/6抑制剂会抑制Rb磷酸化并阻止细胞周期从G1进入S期,从而导致细胞衰老和凋亡。在乳腺癌异种移植模型中,每天不中断服用CDK4/6抑制剂作为单一药物或与抗雌激素药物联合给药,肿瘤体积缩小。此外,正常组织由于拥有更多处于G 0期(休眠期)的细胞而受到保护。
基于当前临床前结果和ER+转移性乳腺癌的临床成功,目前至少有12种CDK4/6抑制剂,包括已获得美国食品和药物管理局批准的三种(表1),超过100项临床试验中进行测试与其他靶向疗法、经典细胞毒化学疗法或免疫疗法相结合,用于广泛的肿瘤类型[10]。癌症中导致CDK4/6过度活化的多种遗传事件强调了适当调节CDK4/6活性对正常组织稳态的重要性。例如,CCND1扩增、CDK4扩增和CDKN2A缺失是多种人类癌症中的常见事件。这些数据证实CDK4/6激酶和相关的细胞周期通路是癌症治疗的重要靶点(图2)。
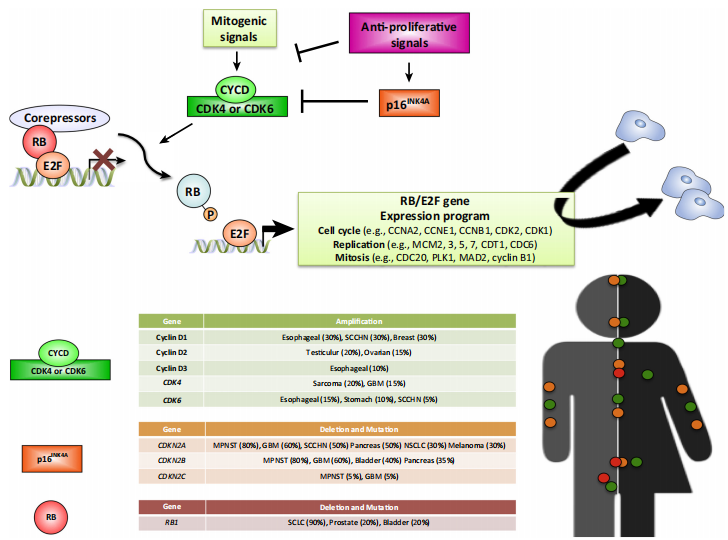
图2 Signaling Integration through the CDK4/6–RB Pathway[11]

CDK4/6抑制剂(CDK4/6i)联合内分泌治疗是激素受体阳性、HER2阴性(HR+/HER2-)晚期乳腺癌的主要治疗方法。然而,原发性或是获得性的耐药性还是时有发生,从而导致治疗失败和癌症进展。原本随着CDK4/6抑制剂的使用范围扩大,研究人员发现它们改善了ER+/HER2−乳腺癌的预后,也可能使HER2+乳腺癌和其他实体肿瘤受益。可是并非所有患者对CDK4/6抑制剂都有反应,甚至对CDK4/6抑制剂敏感的患者也可能产生耐药,因此CDK4/6抑制剂在临床中的应用受到了很大限制,且目前CDK4/6抑制剂的耐药机制尚不清楚。研究者希望通过大样本数据以确定能够预测CDK4/6抑制剂疗效的潜在生物标志物,进而更好地了解患者的基因突变,同时有助于揭示耐药机制和群体差异。
HR阳性和HER2阴性是目前临床上用于选择CDK4/6抑制剂治疗患者的唯一肿瘤生物标志物[12]。如表2-1所示,在CDK4/6靶向治疗中还具有相关性的选定生物标志物。Rb是CDK4/6的主要磷酸化靶点,磷酸化Rb (Prb)的存在是一个重要的生物标志物。一项研究中对于Paloma-2和Paloma-3的分析表明,Cyclin E/CDK2复合体也可能是有用的生物标志物,在接受CDK4/6抑制剂治疗的患者(来自 Paloma-3 的队列)中,Cyclin E1 mRNA的高表达与较短的PFS相关,而在之前未治疗的患者(来自Paloma-2的队列)中,Cyclin E1 mRNA的高表达与较短的PFS无关[12]。此外,存在对CDK4/6抑制剂有耐药性的潜在生物标志物,如表2-2所示。
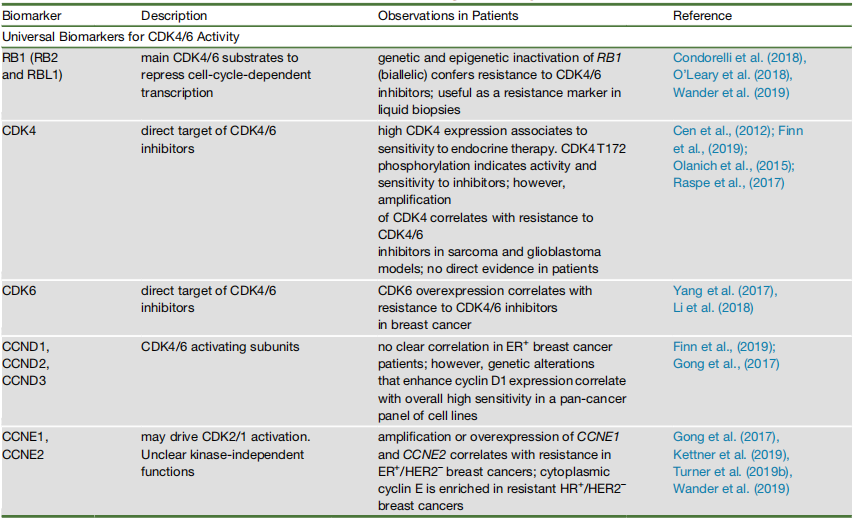
表2-1 Selected biomarkers with putative relevance in CDK4/6-targeted therapies[9]
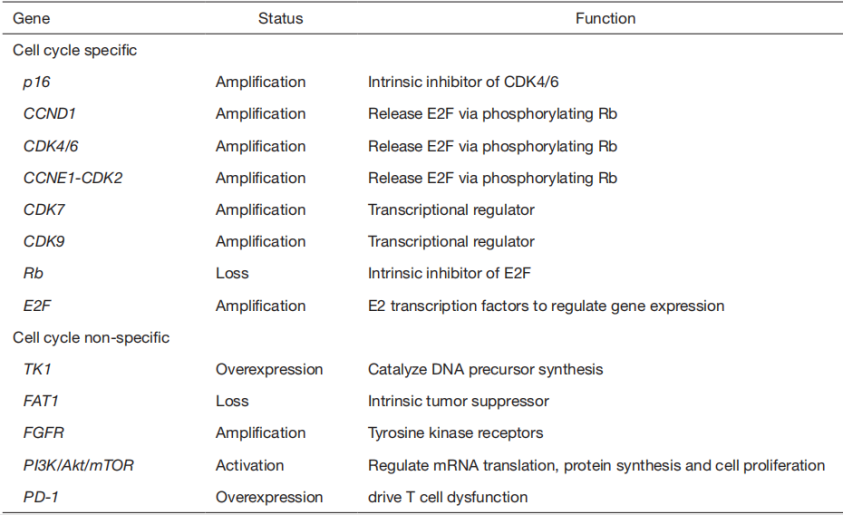
表2-2 Potential biomarkers of resistance to CDK4/6 inhibitors[13]

迈杰拥有行业领先的核酸、蛋白、病理以及细胞生物学等综合性转化医学全平台,覆盖生物标志物开发及验证等转化医学服务、药物临床实验分子检测服务,解决新药研发痛点。基于以上研究,可针对各类研究指标提供CDK4/6抑制剂治疗中生物标志物研究的整体解决方案(表3)。
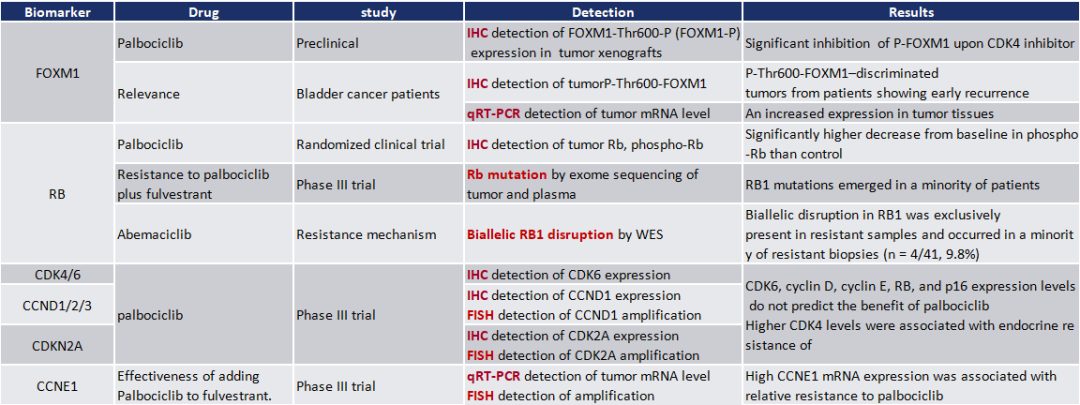
表3 Reported studies of biomarkers
随着研究人员对CDK4/6抑制剂的认识加深,治疗手段的不断进步以及创新药物的研发与引进增多,CDK4/6抑制剂的应用潜力会进一步凸显,无论是乳腺癌还是其他癌种,其在国际市场的上升空间还很大。相信CDK4/6抑制剂一定未来可期!
[1] Du Q, Guo X, Wang M, et al. The application and prospect of CDK4/6 inhibitors in malignant solid tumors[J]. Journal of Hematology & Oncology, 2020, 13(1).
[2] Corona S P, Ravelli A, Cretella D, et al. CDK4/6 inhibitors in HER2-positive breast cancer[J]. Crit Rev Oncol Hematol, 2017, 112:208-214.
[3] Franco J, Balaji U, Freinkman E, et al. Metabolic reprogramming of pancreatic cancer mediated by CDK4/6 inhibition elicits unique vulnerabilities[J]. Cell Rep, 2016,14:979–90.
[4] Logan JE, Mostofizadeh N, Desai AJ, et al. PD-0332991, a potent and selective inhibitor of cyclin-dependent kinase 4/6, demonstrates inhibition of proliferation in renal cell carcinoma at nanomolar concentrations and molecular markers predict for sensitivity[J]. Anticancer Res, 2013,33:2997–3004.
[5] Bollard J, Miguela V, Ruiz de Galarreta M, et al. Palbociclib (PD-0332991), a selective CDK4/6 inhibitor, restricts tumour growth in preclinical models of hepatocellular carcinoma[J]. Gut, 2017,66:1286–96.
[6] Saab R, Bills J L, Miceli A P, et al. Pharmacologic inhibition of cyclin dependent kinase 4/6 activity arrests proliferation in myoblasts and rhabdomyosarcoma-derived cells[J]. Mol Cancer Ther, 2006,5:1299–308.
[7] Hamilton E, Infante JR. Targeting CDK4/6 in patients with cancer[J]. Cancer Treat Rev, 2016,45:129–38.
[8] Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1- phase progression[J]. Genes Dev, 1999,13:1501–12.
[9] Álvarez-Fernández M, Malumbres M. Mechanisms of sensitivity and resistance to CDK4/6 inhibition[J]. Cancer Cell, 2020,37: 514-29.
[10] Marcos M. CDK4/6 Inhibitors: What Is the Best Cocktail?[J]. Clinical Cancer Research, 2019, 25(1).
[11] Knudsen E S, Witkiewicz A K. The Strange Case of CDK4/6 Inhibitors: Mechanisms, Resistance, and Combination Strategies[J]. Trends in Cancer,2017,3(1):39-55.
[12] 袁晓莉, 王振波. CDK4/6抑制剂在HR+/HER-2−乳腺癌中耐药机制及生物标志物研究进展[J]. 临床医学进展, 2021, 11(12): 5754-5761.
[13] Huang W, Wang H, et al. Potential biomarkers of resistance to CDK4/6 inhibitors: a narrative review of preclinical and clinical studies[J]. Transl Breast Cancer Res 2021,
央视《匠心》栏目视角看迈杰转化医学